Ah, a Química! Essa disciplina está ao nosso redor em tudo o que fazemos. De manhã, ao passar aquele cafezinho, estamos realizando um processo químico. Ao deslizar o lápis no papel e transferir o grafite para o caderno, também visualizamos uma alteração física com conceitos químicos. E por aí vai!
Além de fazer parte de nosso dia a dia, a Química também é um importante componente do vestibular. Seja no Enem ou em outras provas, a presença de temas relacionados a essa disciplina é constante. E, para mandarmos bem nessa matéria, é fundamental que entendamos também os conceitos básicos.
Um dos mais fundamentais é a distribuição eletrônica, assunto que permeará ao longo de todo o seu estudo da Química e será essencial para a compreensão de conceitos mais complexos. Tudo pronto para dar mais esse passo rumo ao aprendizado? Então, vamos lá!
O que é a distribuição eletrônica?
Para estudar para o vestibular e o Enem, além de conhecer os elementos periódicos, é interessante saber outros conceitos básicos e fundamentais para a compreensão de toda a química. A distribuição eletrônica é uma ferramenta importante para que possamos conhecer a quantidade de energia (carga) de um átomo.
Conforme estudado com o modelo atômico de Rutherford-Bohr, os átomos são estruturas que possuem órbitas energéticas ao seu redor. São nelas que os elétrons “passeiam”, pulando de uma camada para a outra conforme o átomo ganha ou perde energia (ou seja, se torna cátion ou ânion).
O modelo (ou diagrama) de distribuição eletrônica foi pensado por Linus Pauling, e é conhecido por esse nome.
Ao todo, são 7 camadas energéticas (ou órbitas) ao redor do átomo. Nem todos os átomos terão todas as camadas completas. É isso que os difere em relação à quantidade de energia, como veremos mais à frente.
Lembrando que conhecer os níveis energéticos também é fundamental para entender a posição dos elementos na tabela periódica. E, com isso, compreender, também, as suas propriedades.
A partir da distribuição do diagrama de Linus Pauling, você consegue descobrir:
- o tipo de ligação que o elemento faz;
- onde ele está na tabela;
- qual é o seu grupo ou família;
- se é um metal ou um ametal;
- se ele perde ou ganha elétrons com facilidade;
- se é um elemento instável ou estável;
- se é básico ou ácido;
- questões como o raio atômico e a eletronegatividade dos elementos;
- qual é a sua fórmula estrutural.
E muito mais!
O que são os níveis e subníveis energéticos?
Os níveis energéticos são conhecidos pelas seguintes letras do alfabeto: K, L, M, N, O, P e Q. Eles correspondem, respectivamente, aos números 1 ao 7 e são observados de dentro para fora ou do centro para a extremidade.
Em outras palavras, o nível K é o que se encontra mais próximo ao núcleo. O Q (7), mais distante.
Além disso, temos também os subníveis. Cada nível há um “espaço” dentro deles, nos quais os elétrons “se encaixam”. Essa é apenas uma analogia, ok? Pense nos níveis como se fossem caixas de tamanhos diferentes. Em cada uma delas, cabe uma certa quantidade de elétrons.
Os subníveis são: s, p, d, f. Assim mesmo, em minúsculo!
Como fazer as classificações?
A classificação dos níveis é feita a partir do nível máximo de elétrons que cada um deles suporta. Confira!
Níveis:
- K — 2 elétrons;
- L — 8 elétrons;
- M — 18 elétrons;
- N — 32 elétrons;
- O — 32 elétrons;
- P — 18 elétrons;
- Q — 8 elétrons.
Não é tão difícil de lembrar, concorda? Note que há uma certa regressão a partir do número 32. Assim fica mais fácil!
Na hora de montar a distribuição, você pode usar os números de 1 a 7 no lugar das letras. Tá tudo certo!
Os subníveis, por sua vez, suportam:
- s — 2 elétrons;
- p — 6 elétrons;
- d — 10 elétrons;
- f — 14 elétrons.
Tá, mas como posso usar essas informações do modo certo? É, realmente esses conceitos podem parecer abstratos à primeira vista. Mas não se preocupe! A seguir veremos um exemplo prático e certamente tudo ficará mais claro em sua mente. Vamos lá?
Como fazer a distribuição eletrônica?
Vamos utilizar como guia o elemento bário, que tem número atômico equivalente a 56. Utilize as listas acima para acompanhar!
A primeira camada de energia é, obrigatoriamente, o K. Como ela suporta 2 elétrons, o seu subnível é o s. Logo, ficamos com: Ks2 ou simplesmente 1s2.
Agora, vamos continuar. A segunda camada é o L, que suporta 8 elétrons. Logo, teremos Ls2 Lp6 (ou 2s2 e 2p6), totalizando 8 elétrons.
A próxima é o M, que suporta 18 elétrons. Para preenchê-la, utilizaremos o Ms2, Mp6 e Md10. Deu para entender?
Agora, continue fazendo. Não se esqueça que você não precisa preencher todos os grupos. Exemplo: se você deseja atingir o número 17, pode usar os subníveis s2, p6 e d9. Entendeu? Não precisa ir até o 10 no último subnível!
Como as questões sobre o assunto aparecem no Enem?
A prova de Química no Enem costuma cobrar questões de dois tipos. O primeiro traz perguntas contextualizadas, ou seja, voltadas para temas como o uso de energia sustentável, a participação da Química em nosso dia a dia, o que faz a matéria no setor de Engenharia Elétrica ou Ambiental, entre outras.
O segundo tipo nos cobra conhecimentos conceituais. É aqui que entra a distribuição eletrônica, tema que pode ser cobrado diretamente no decorrer de sua prova. Por isso, é sempre bom incluir a matéria no seu plano de estudos para o Enem.
Como esse tema é cobrado nas provas?
Agora, veremos um exemplo de questão sobre distribuição eletrônica que já apareceu no caderno de Ciências da Natureza e suas Tecnologias em uma das edições do Enem. Vamos lá?
(Enem 2018) O grafeno é uma forma alotrópica do carbono constituído por uma folha planar (arranjo bidimensional) de átomos de carbono compactados e com a espessura de apenas um átomo. Sua estrutura é hexagonal, conforme a figura.
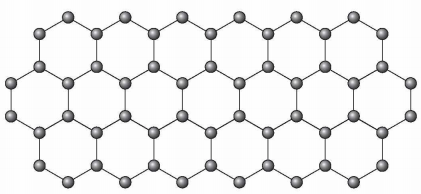
Nesse arranjo, os átomos de carbono possuem hibridação
a) sp de geometria linear.
b) sp2 de geometria trigonal planar.
c) sp3 alternados com carbonos com hibridação sp de geometria linear.
d) sp3d de geometria planar.
e) sp3d2 com geometria hexagonal planar.
Resposta: letra b.
Como podemos ver, essa é uma questão um pouco mais complexa, que mistura o tema de distribuição eletrônica com conceitos de geometria molecular. Por isso, não se preocupe caso você não tenha conseguido resolvê-lo, ok? Aos poucos, você vai se familiarizar com novas informações e poderá retornar a essa questão e acertar tudo!
Não pare por aqui!
Gostou de saber mais sobre a distribuição eletrônica? Agora chegou a hora de treinar e fazer um montão de questões sobre o assunto (conte com as provas anteriores do Enem para isso!) Dessa forma, você conhecerá mais os conceitos e conhecerá uma série de informações novas e importantes para o exame.
Aproveite e faça o download gratuito de nosso e-book Ciências Exatas e da Terra: guia para estudar e conquistar uma boa nota. Ele vai te ajudar muito no estudo da Química e demais matérias do caderno!











